Innledning
En veileder for leger som utreder og behandler pasienter med mistanke om eller som har fått bekreftet lungeembolier (LE), ankommet Akutten eller på avdeling
Søkerord: lungeemboli, utredning og behandling (pulmonary emboli, venous thrombosis, management and treatment, guidelines)
Hensikt og omfang
Veilederen omfatter utredning og behandling av lungeemboli, men den omfatter ikke pleiedelen for pasienter med lungeembolier.
Ansvar
Leger som utreder pasienter hvor det foreligger mistanke om eller som har fått bekreftet lungeemboli, uten at veilederen er bindende.
Arbeidsbeskrivelse
Utføres av: leger som har ansvar for utredning av lungeemboli. Veilederen er forøvrig tilgjengelig for alle avdelingers ansatte.
Arbeidsoppgave:
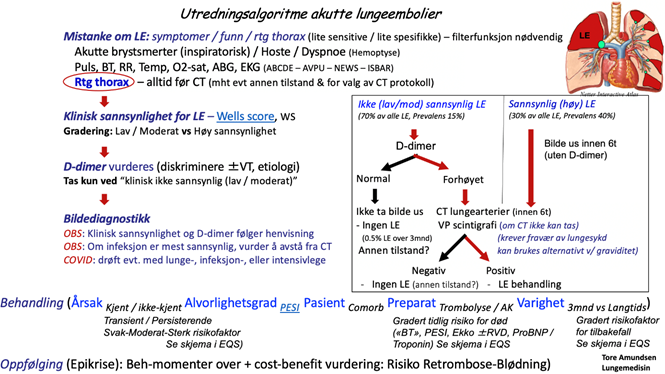
I. Utredning – mistanke om LE krever øhj. vurdering (se også «Pasientforløp tung pust»)
Lungeemboli (LE) er en venøs trombose (VT) med eller uten dyp venetrombose (DVT). Mistanke om lungeemboli baseres ofte på uspesifikke symptomer og funn, fra hoste til akutte brystsmerter og tungpust, til sjokk og død. Symptomer og funn har lav sensitivitet og lav spesifisitet, og er alene ikke tilstrekkelig for eksakt diagnose. Endelig diagnose baseres derfor på bildediagnostikk
Utfordring: Begrense bildediagnostikk til risikogruppen med høyere sannsynlighet for LE og det benyttes to filterfunksjoner: 1. Klinisk sannsynlighet (spørreskjema, f.eks. Wells score, WS) og 2. D-dimer (Se «Relatert»)
1. Klinisk sannsynlighet (KS) for LE: graderer risikogrupper etter 1) Lav, middels eller høy klinisk sannsynlighet for tilstanden eller 2) Ikke sannsynlig versus Sannsynlig LE.
Lav og middels klinisk sannsynlighet (ikke sannsynlig LE) utgjør den største gruppen (innehar også de fleste LE – 90%, men har lavere prevalens enn den mindre gruppen med høy sannsynlighet): 1) Lav (10%), middels (30%) eller høy (65%) eller 2) Forenklet versjon: Ikke-sannsynlig LE (12%) vs Sannsynlig (30%).
Wells score for LE (klikk) er én av flere mulige standardiserte verktøy for KS vurdering, finnes på nett, hvor en fyller ut «Ja = 1 / Nei = 0» i skåringskjema, og gir en tallverdi som angir lav, middels eller høy sannsynlighet for LE (tre-trinns) eller sannsynlig – ikke sannsynlig (to-trinns), hhv original vs forenklet versjon.
Geneva score, GS, evt. PERC rule eller YEARS skår er alternative tester. De to sistnevnte krever lav (< 10 – 15%) prevalens for LE i aktuelle populasjon, har linker og omtale på nettsiden (en velger å avvente validering med flere prospektive studier før evt. implementering her). Original, modifisert og forenklet versjon av WS (og GS) finnes, og er validert i kliniske studier og valgt for vårt formål (medisinsk mottak med rundt 20-40% prevalens av sykdommen i henvist populasjon)
2. D-dimer (sluttproduktet i fibrinolysen, en kvantitativ blodprøve) diskriminerer for ± VT etiologi og er indisert i den store gruppen med lav eller middels klinisk sannsynlighet. Negativt prøvesvar kan indikere tilstander uten tromboseetiologi og positivt prøvesvar indikerer tromboseetiologi (fibrinolyseaktivitet). Aldersjustert D-dimer (validert metode, cut-off verdi = Alder x10/1000mg/L) er et alternativ for pasienter >50år, og reduserer behovet for bildediagnostikk (OBS – det er begrensninger i studiens utsagnsverdi). De med lav eller middels klinisk sannsynlighet + pos D-dimer, og de med alene høy klinisk sannsynlighet får utført bildediagnostikk.
3. Bildediagnostikk: CT lungearterier eller Ventilasjons- perfusjon scintigrafi, VP SPECT) avklarer endelig om LE diagnose (eller DVT) foreligger.
Gradering av disponerende faktorer (ESC-guideline LE 2019)
- Sterke faktorer (OR ≥10)
- Fraktur underekstremitet
- Hofte- eller kneoperasjon (protese)
- Stort traume, spinaltraume
- Tidligere VT
- Hospitalisering for AMI, hjertesvikt, atrieflimmer/flutter siste 3 mnd.
- Middels sterke faktorer (OR 2-9):
- Artroskopisk knekirurgi
- Aktiv autoimmun sykdom, blodtransfusjon
- CVK, i.v.-kateter / linjer, kjemoterapi
- Hjerte- og / eller lungesvikt
- Bruk av EPO, HRT, p-pille, in-vitro fertilisering, post-partum
- Infeksjon (UVI, NLI, HIV)
- Inflammatorisk tarmsykdom, kreft, overfladisk VT, trombofili
- Paralytisk slag
- Svake risikofaktorer (OR <2):
- Sengeleie > 3dg, immobilisering sittende (bil, fly o.l)
- Diabetes, hypertensjon,
- Høy alder
- Laparoskopisk operasjon, overvekt, graviditet, varikøse vener
Graviditet – egen utredningsalgoritme (se figur under):
1. Klinisk sannsynlighet – test kan ikke brukes med sikkerhet ved graviditet
2. D-dimer – begrenset nytte ved LE-diagnostikk (men ordinær algoritme brukes)
3. Bildediagnostikk – eneste sikre test ved LE-diagnostikk ved graviditet (hvor det er naturlig å starte med Ultralyd vener underekstremitet
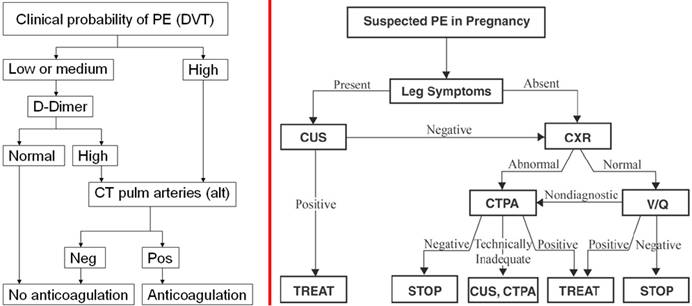
Husk: DVT i bekkenvener utelukkes ikke med CUS (compression UltraSound)
Husk: Scintigrafi (VP SPECT) krever normalt rtg thorax, samt ingen kjent luftveis- eller lungesykdom (som ofte ikke detekteres på rtg thorax), for eksempel astma bronkiale eller lavgradig interstitiell lungesykdom, alveloitis eller polyangeitis (som kan gi falskt positiv scintigrafi, mismatch av annen årsak enn LE). CT lungearterier bør da vurderes for sikker diagnose (bekrefte eller avkrefte), samt vurdering av differensialdiagnoser. VP- scintigrafi, VP- SPECT og CT lungearterier mht. absorbert stråledose for foster og mor (ESC PE Guideline 2019 (Figur 6 og 12)). Dagens protokoller gir begrenset forskjell. Det er usikkert om mer raffinerte bildemetoder gir praktisk klinisk nytteeffekt (Dual energy CT, DECT iodine maps – Weidman, Radiology 2018)
Prognostisk vurdering (mht. behandling) – Alvorlighetsgrad/ risiko for tidlig død
Faktorer: Hemodynamikk/ Klinikk (PESI skår)/ Right Ventricular Dysfunction (RVD) (transthoracal ekkokardiografi (TTE) evt. CT lungearterier (CTa)) / Markør (ProBNP)
Hemodynamikk:
|
Hjertestans |
Obstruktivt sjokk |
Vedvarende BT <90 |
|
Trenger HLR |
BT <90mmHg, eller vasopressor trengs for å holde BT >90mmHg (godt væsket) |
Ev BT fall >40mmHg Varighet > 15min |
|
|
og «endeorgan-hypoperfusjon» Kald/klam/mentalt endret/oliguri/lactat opp |
Uten arytmi, sepsis eller hypovolemi |
Risikobasert behandling: Lav – Middels – Høy risiko LE, for tidlig død
|
Tidlig risiko for død |
Risikoindikatorer |
||||
|
Hemodynamisk instabiliteta |
Klinisk alvorlighet PESI skår III-IV eller sPESI ≥1 |
RVD (TTE eller CTa)b |
Kardial markørc (Troponin /ProBNP) |
||
|
Høy |
+ |
(+) |
+d |
(+) |
|
|
Moderat |
Middels høy |
- |
+e |
+ |
+ |
|
Middels lav |
- |
+e |
Én (eller ingen) pos |
||
|
Lav |
- |
- |
- |
Vurdert v/behov Hvis vurdert, neg |
|
(Se Relatert: ESC PE Guidelines Nye og Endrede anbefalinger fra 2014 til 2019)
a – én av de tre presentasjoner (hjertestans, obstruktivt sjokk, vedvarende BT<90mmHg)
b – Jfr Figur 3 i ESC PE Guideline 2019 (CTa og/ eller Ekko cor)
c - markørene er studert i små studier, og foreløpig ikke brukt i klinisk praksis
d – tilstrekkelig med hemodynamisk instabilitet og RVD for å bestemme «høy risiko LE»
e – RVD (CTa eller Ekko cor) og markør (troponin / ProBNP) overgår PESI eller sPESI (≥ eller 0)
Lav – Middels høy risiko for tidlig død
Antikoagulasjonsbehandling får de med bildeverifisert LE. Dersom negativ bildediagnostikk, anbefales utredning av evt. annen tilgrunnliggende sykdom. Algoritmen sikrer kostnadsffektiv bruk av D-dimer og bildediagnostikk og utelukker LE med ca.99% (negativ prediksjonsverdi) i påfølgende 3 – 6 måneder
II. Behandling (Se www.blodfortynnende.no, Felleskatalogen.no, Norsk legemiddelhåndbok)
Akutt behandling ved mistanke om LE:
Oksygen: 5-10 L/min, forsiktig hos pasienter med alvorlig KOLS som kan få 1-2 L/min inntil avklaring, Morfin 5-10 mg i.v. ved svære smerter og angst initialt (Obs! forsiktig ved KOLS), alternativt kombinasjon tabletter paracetamol – codeinfosfat. LMWH kan startes under utredning ved moderat og sterk mistanke om LE, obs kontraindikasjoner (Felleskatalogen.no).
Parenteral antikoagulasjon: LMWH (low molecular weight heparin) s.c. i terapeutiske doser initialt. Aktuelle preparater og doser er Klexane® (enoxaparin): 1,5 mg/kg x 1 s.c. eller 1,0 mg/kg x 2 s.c. daglig, Fragmin® (dalteparin): 100 i.e. per kg x 2 daglig. Obs 90% renal eliminasjon, nyrefunksjons-avhengig dosering, evt. mål anti-FXa (PT-INR og APTT-test er ikke egnet). Pasientene kan mobiliseres og vurderes for utskrivning etter etablert diagnose og oppstartet antikoagulasjon, ofte dagen etter innkomst, såfremt klinisk tilstand tillater det (se PESI senere i veilederen)
Peroral antikoagulasjon med direkte orale antikoagulasjonsmidler (DOAK) – er førstevalg dersom ikke kontraindikasjoner. F.eks. oppstart: apiksaban: Eliquis® 10mg x 2 i 7 dager, deretter 5mg x 2. Felleskatalogen.no.
Alternativt: Rivaroksaban: Xarelto® 15mg x 2 i 21 dager, deretter 20mg x 1 Dabigatran: Pradaxa® 150mg x 2 (startes etter 5d LMWH initalbehandling) Edoksaban: Lixiana® 60mg x 1 (startes etter 5d LMWH initalbehandling). Obs interaksjoner (CYP og, se Felleskatalogen for dosejusteringer).
For de godkjente indikasjoner er DOAK ikke dårligere enn standard etablert antikoagulasjonsbehandling, men en må utøve nøye vurdering før oppstart og under oppfølging. Individuell vurdering av antikoagulasjonsbehandling gjøres på bakgrunn av graviditet og amming (kontraindisert), APA (antifosfolipianantistoff-syndrom) skal ikke ha DOAK, men Marevan, komorbiditet (kreft vurderes spesielt), samt alder, vekt, nyrefunksjon, blødningsrisiko (lokal og generell), compliance, antitrombotisk medikasjon og legemiddelinteraksjoner (CYP og p-GP)
DOAK har innbyrdes ulik farmakokinetikk / -dynamikk (også i forhold til initial LMWH). DOAK har tidligere ikke hatt antidot, men antidot Praxbind® (idarucizumab) finnes for Pradaxa, og ser foreløpig ut til å ha effekt på anti-Xa preparatene (Praxbind® finnes på «akutt medisinlager» her på St. Olavs, alternativt AndexXa® eller tilsvarende). For øvrig følges Felleskatalogens veiledning for de enkelte preparater (antidot aktivert FVIIa er et alternativ)
Peroral antikoagulasjon med Marevan®: Første dag (når diagnosen er sikker) startes peroral antikoagulasjon, f.eks. med warfarin (Marevan®), oftest 3 tabl (7.5mg) daglig første 2 dager, deretter dose justert etter tilstrebet PT-INR verdi 2.0-3.0 (2.5 ± 0.5), og samtidig startes LMWH (dersom det ikke allerede er startet under utredningen på sterk mistanke). LMWH seponeres ved oppnådd PT-INR nivå >2.0 i minst 24t (LMWH og Marevan tilstrebes overlappet minimum 5dager).
Behandlingslengde: se «Relatert» «Momenter ved langtidsbehandling Juni 2020)
Tilbakefallsrisiko av LE og Risikofaktorer og Behandlingslengde
|
Risiko for tilbakefall |
Risikofaktor |
Eksempler |
|
Lav (< 3%/år) |
«Major» transient / reversibel >10 ggr økt risiko Index-VT |
Kirurgi – anestesi > 30min Sengeleie/ sykehus >3dg (akutt) Traume / Fraktur |
|
Moderat (3 – 8%/år) |
Transient / reversibel <10 ggr økt risiko Index-re-VT |
Minor kirurgi – anestesi < 30min Sengeleie/ sykehus >3dg (akutt) HRT / OC / gravid / puerperium Ue traume >3dg (immob) Lang flytur (>6t) |
|
Non-malign, permanent |
IBD, autoimmun sykdom (aktiv) |
|
|
Ingen detektrert |
|
|
|
Høy (> 8/%år) |
Trombofili vurderes av hematolog |
Aktiv kreft, ≥ 2VT (uten major transient / reversibel faktor), APA |
Etter ESC PE Guidelines 2019 (Jfr. Baglin, Ioro, ISTH). Termene «provosert», «uprovosert», «idiopatisk» og «spontan» VT utgår
• Korttidsbehandling 3mnd (transient risikofaktor)
- Lav risiko for tilbakefall av VT, «Major og transient index risikofaktor»
- Moderat risiko for tilbakefall av VT, «Moderat og transient index risikofaktor», kan vurderes for > 3mnd behandling individuelt
Langtidsbehandling (> 3mnd) med vedvarende risikofaktor
- Høy risiko for tilbakefall av VT: aktiv kreft, ≥ 2VT (uten major transient / reversibel faktor), APA
- Moderat risiko for tilbakefall av VT, og non-malign permanent disposisjon, samt ved ikke detektert eller ukjent risikofaktor
- Vurder også minor transient / reversibel årsak, samt trombofili
- Risiko for blødning (lav / moderat / høy)
- Kost-Nytte (VT tilbakefalls- versus blødningsrisiko)
- Anbefaling for langtids-antikoagulasjon (sterk/svak)
- Pasientens ønske
- Konklusjon (tilstreb mest effektive og tolerable behandling)
- Kontroll og oppfølging (minst hvert år): hematologiske parametre, lever- og nyrefunksjon, evt. dosejustering (langtidsbehandling med minste effektive og tolerable dose, hvor dosehalvering kan være et godt alternativ)
- Trombofili: det er vanligvis ikke indisert å teste på trombofili (absolutt eller funksjonelt nedsatt nivå av ATIII, PC, PS, APC resistens, eller Faktor V Leiden og Trombinmutasjon, samt lupus-antikoagulant og fosfolipid-antistoffer), da disse vanligvis ikke påvirker behandlingens intensitet eller lengde (i forhold til uprovosert VT), og hereditære trombofili faktorer påvirker ikke overlevelse eller forekomst av post-trombotisk syndrom. Konferer eller henvis hematolog ved spørsmål om trombofili og blødningstendens, spesielt dersom det ingen klar eller forbigående årsak til LE, ved familiær forekomst, hos pasienter < 45år, samt ved spørsmål om behandlingslengde, eller økt blødningstendens
Aktiv kreftsykdom og lungeemboli: Valg av antikoagulasjonsbehandling hos pasienter med kreft gjøres i spesialisthelsetjenesten og pasientene vurderes individuelt
LMWH: lenge vært best dokumentert og derfor vært generelt foretrukket fremfor warfarin og DOAKs. Videre har LMWH kortere T1/2 enn DOAKs og Marevan, lettere å dosejustere ved utredning (biopsi) eller behandling (f.eks. kirurgi og kjemoterapi). LMWH har effektiv antidot, i motsetning til begrenset tilbud eller tilgjengelighet av antidot og klinisk effekt ved de ulike DOAKs)
DOAKs kan brukes når det ikke foreligger kontraindikasjoner, hvor hver enkelt pasient anbefales vurdert individuelt og vurderes med særskilt forsiktighet ved nedsatt nyre- og leverfunksjon, trombopeni, kirurgi og biopsier, medikamentelle interaksjoner med CYP3A4 og P-glycoprotein, og pasienter med nedsatt GI-adsorpsjon, eller type kreft hvor colorektal- og urogenital er assossiert med økt blødningstendens), og er forsiktig anbefalt i sentrale guidelines (edoxaban, rivaroxaban og apixaban). Ulike DOAKs har innbyrdes ulik farmakokinetikk / -dynamikk (også i forhold til initial LMWH medisinering). Antidot Praxbind® (idarucizumab) finnes for Pradaxa. AndexXa® eller aktivert FVIIa kan være et alternativ, men generelt er effektiv antidot begrenset tilgjengelig
Dokumentasjon ved kreftassosiert venøs trombose og DOAKs: det foreligger etter hvert bedre dokumentasjon, men det er behov for mer, ikke minst mellom ulike DOAKs (ikke bare LMWH vs ulike DOAKs i toarmede studier). Hokusai- (edoxaban), Select-D (rivaroxaban), ADAM VTE (apixaban), Caravaggio (apixaban) og CAP-studiene (apixaban) har generelt inkludert relativt friske kreftpasienter og fra 20-54% tilfeldig påviste venøse tromboser, samt ekskludert ECOG 3 og 4 (foruten CAP studien) og ekskludert pasienter med forventet levetid < 3-6mnd, Caravaggio-studien ekskluderte hjernemetastaser og primære hjernetumores, ingen hadde plater <50x109 /L eller Cl Kr <30 mL/min – altså mer selektert pasientmateriale enn mange av våre kreftpasienter (og dermed ikke utsagnsverdi for hele gruppen av kreftpasienter, hvorfor en bør vurdere hver enkelt kreftpasient sin egnethet for DOAK)
Valg av preparat avhenger av indikasjon, kontraindikasjoner og pasientrelaterte faktorer – spesielt bør en utøve spesiell forsiktighet ved colorectal- og urogenital kreft (økt blødningstendens, men variasjoner innom DOAK gruppen).
• Risiko for alvorlig blødning: Lav 0.8%/år, Moderat (1 årsak): 1.6%/år, Høy: ≥ 6.5%/år (≥ 2 årsaker): alder >65, ukontrollert hypertensjon, og komorbiditet (ulike medisinske og kirurgiske tilstander), spesielt GI- og urotelial kreft, tidligere blødning, trombopeni, GI-traktsykdom, lever / nyresvikt, anemi, kreft og krefttype, CVI eller intracerebral krefttilstand, DM, annen antitrombotisk behandling, nylig kirurgi, falltendens etc. Alkoholmisbruk.
- Kost-benefit for pasienten: anbefalt dosering, antikoagulasjonsnivå og varighet må alltid vurderes opp mot individuell risiko for retrombose og blødning (se over), cost – benefit, effekt – bivirkning, sterk og svak indikasjon.
Gravide skal aldri ha Marevan®, men derimot LMWH (utredning og behandling er en spesialist-oppgave). DOAK er kontraindisert under graviditet eller amming
Screening for okkult kreftsykdom: Okkult kreftsykdom opptrer kun i 3-5 % ved ved kjent årsak (sterke eller middels VT disponerende faktorer, ofte transiente), og screening er ikke funnet generelt indisert. Ved VT uten kjent årsak (eller svak transient / reversibel disponerende faktor) opptrer okkult kreft i 4-15%, og behov for screening synes rimelig å utføre. «Enkel screening» er oftest tilstrekkelig (anamnese, generell klinisk undersøkelse, inklusive lymfeknuter, mammae / rektal-, prostata og testis eksplorasjon, lab-prøver som Hb, hct, hvite (diff), plater, ALAT, ALP, GT, kreatinin/ eGFR, Ca, PSA, SR, CRP, urin stix, Hemofec og rtg thorax, samt mammografi og GU dersom ikke tatt siste året, mens «Utvidet screening» (samme som over, samt US abd-bekken, CT th-abd-bekken) kan vurderes på individuell basis ved klinisk-anamnestisk sterkere kreftmistanke (Husseinsadeh & Carrier Thromb Res 2017 og Semb Tidsskr Nor Legeforen 2014)
Melding av bivirkninger til RELIS (spesielt viktig ved nye legemidler)
Høyrisiko LE (alvorlighetsgrad og risiko for tidlig død, se Prognostisk vurdering over)
Generell intensiv behandling: tilstrebe korreksjon av hemodynamisk forstyrrelse (hjerte- lungeredning ved hjertestans, gjenopprette blodvolum og vurdere pressor / inotroper, ved akutt høyre ventrikkel dysfunksjon/ svikt, obstruktivt sjokk eller vedvarende hypotensjon og respiratorisk behandling (ventilasjon og oxygenering, non-invasiv eller invasiv) på hjerteintensiv overvåkningsavdeling, samtidig som en vurderer å gi adekvat fibrinolytisk behandling (nøye vurdere indikasjon og kontraindikasjon)
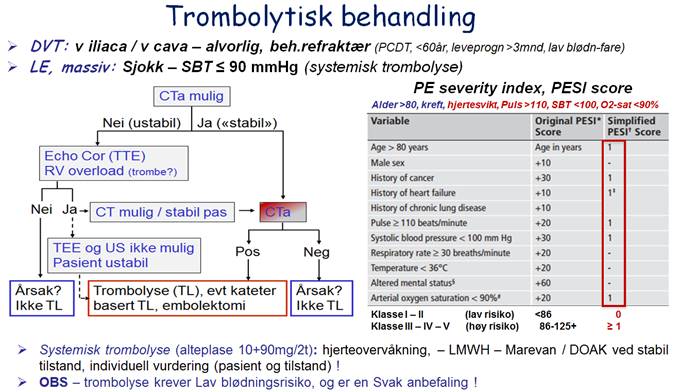
Trombolyse
Indikasjon (trombolyse vurderes): systemisk trombolyse vurderes ved akutt massiv LE, kardiopulmonalt derangert pasient med hypotensjon/sjokk og akutt høyre ventrikkel dysfunksjon (Ekkokardiografi / PESI score), spesielt hos yngre pasient uten økt blødningstendens eller kontraindikasjoner på trombolyse. Forsiktighet må utvises hos pasienter som har hatt cardio-pulmonal resuscitasjon (CPR helst <10min) da de har økt blødningsfare. Oftest anvendes infusjon 100 mg rtPA (alteplase) over 2t, se Felleskatalog, for eksempel Actilyse®. Dersom trombolytisk behandling planlegges skal pasienten overflyttes/innlegges hjertemedisinsk intensiv / hovedintensiv, for behandling og overvåkning. Disse pasientene har ofte betydelig forhøyet systolisk lungearterietrykk og er truet av høyresidig hjertesvikt. De kontrolleres med ekkokardiografi under forløpet, og etter utskrivning fra Klinikk for hjertemedisin følges de opp ved hjertemedisinsk poliklinikk i samarbeid med primærlegen.
Kontraindikasjon (trombolyse): cerebrovasculære insult (aneurismer/ blødning/ ischemisk hjerneinsult), ansikts-hjernetraume, nylig kirurgi på hjerne / spinale strukturer, blødninger < 4uker.
Relativ kontraindikasjon: alder >75år, aktuell antikoagulasjon, graviditet, ikke komprimerbare (større) arterielle punksjoner, HLR >10min, ukontrollert HT (≥180/110), GI-blødning, kirurgi < 3uker.
Lokal iv trombolyse (catether directed thrombolysis, CDT) av LE er ikke godt dokumentert, og en bør unngå systemisk iv trombolyse over dager. Embolektomi (trombendarterektomi) overveies hos kritisk dårlige pasienter som er alvorlig sirkulatorisk kompromittert og medisinsk behandling anses uaktuell pga. tidsfaktoren, ved absolutte kontraindikasjoner mot trombolytisk behandling, eller ved manglende effekt av trombolytisk behandling (økende cardiopulmonal derangering). Risikoen for intrakraniell blødning er «høy» etter trombolyse og blødningsrisikoen bør vurderes meget nøye på forhånd. («Relatert»: ESC PE Guidelines 2019 og ESC PE Guidelines Nye og Endrede anbefalinger 2019)
Nytteverdien av trombolyse i populasjoner av uselektert submassiv LE (høyre ventrikkel dysfunksjon uten hypotensjon) er fortsatt omdiskutert, det samme med tilleggsverdien av blodprøver som troponiner og proBNP mhp. klinisk beslutningsverdi for behandling. Beste indikasjon er massiv LE med cardiopulmonalt derangert pasient, ofte sjokk og besvimelse (hvor mortaliteten er høy, minst 45%). Videre diskuteres reduserte doser av trombolytiske preparat (for eksempel tenecteplase som ikke er registrert i Norge) for fremtidige studier (Meyer NEJM 2014 og Curr Atheroscler Rep 2015, Vedantham J Thromb Thrombolysis 2016), ESC PE Guideline EHJ 2019 argumenterer for oftere vurdering av trombolyse, se denne.
Venefilter i v. cava inferior kan være aktuelt hos de dårligste med kontraindikasjoner for nedenstående tiltak, men er ikke ofte brukt i Norge.
Behandling som inneliggende, obs post Akutt24 eller poliklinisk – pasientlogistikk
PESI score (Pulmonary Embolism Severity Index) med Advice, Management and Critical actions, simplified PESI, HESTIA criteria, Geneva prediction rule, the Low-Risk Pulmonary Embolism Decision rule (LR-PED) og the Global Registry of Acute Cardiac Events) kan brukes til å bestemme prognose og planlegge behandling og oppfølging som inneliggende eller poliklinisk (spesielt i initialfasen), og her er PESI score valgt. Modellene skiller godt mellom de som bør behandles inneliggende (høy risiko for reinnleggelse og død) og de som kan behandles poliklinisk (lav risiko for reinnleggelse og død) (Barra Clin Cardiol 2013). Om du er i tvil, og / eller ikke får drøftet med lungebakvakt innkomstdagen kan pasienten innlegges og det utføres vurdering påfølgende dag.
Prognose: Epidemiologiske data tyder på at rundt 25% av alle LE debuterer med død (ofte ukjent premortal diagnose), rundt 30 % mortalitet ved ubehandlet LE, «30days all cause mortality»1-8 % hos pasienter som behandles for LE, men mortalitet vil avhenge av lungeemboliens omfang og pasientens alder, komorbiditet og tilstand (Kline PE Part 1 J Emerg med 2015). Tilbakevendende LE opptrer årlig i 2.5- 5 % ved adekvat behandling, men varierer og avhengig av pasientens risikoprofil for trombose (Heit J Thromb Thrombolysis 2016). Blødning er relativt hyppig, avhengig av alder, medisiner og komorbiditet samt behandlingsvarighet, 2-3 alvorlige blødninger pr 100 behandlingsår med Marevan som antikoagulasjon (Sandén J Thromb Thrombolysis 2016). Uavhengige faktorer som øker blødningstendens er alder, anemi, tidligere blødning, hjertesvikt, kronisk lunge sykdom, alkoholmisbruk og hypertensjon.
Generelt om sykdom, årsak, behandling og prognose. Pasientene må informeres nøye om risikofaktorer for blødning og om symptomer på mulig tilbakefall. Rask legekontakt er viktig med tanke på tidlig diagnose og behandling. Kombinasjons p-piller anbefales ikke etter lungeemboli, og heller ikke østrogensubstitusjon i klimakteriet eller senere. Generell muntlig informasjon om tilstand og behandling (effekt og bivirkninger). Anbefales å dele ut Marevanfolder (skriftlig informasjon) og Marevan-PT-INR-doseringskort er obligatorisk å utruste pasienten med, og medbringes til primærlegen som har senere kontroll og oppfølging. Anbefaler eget pasient informasjonskort også ved de nye «direkte orale antikoagulasjons midler», og spesielt nøye oppfølging ved oppstart av nye preparater, se over (behandling). Husk melding av bivirkninger til RELIS.
III. Utskrivning og oppfølging:
- Klinisk tilstand (alvorlighetsgrad) avgjør tid for utskrivning, vurderes fra og meddag 2 (dagen etter innkomst) om tilstanden krever innleggelse– se figurer over (PESI skår) hvor rask utskrivning anses som trygt ved lav risiko (klasse I –II PESI score)
- Pasientinformasjon: Marevan-veileder (Nyco-Med) og PT-INR-Marevan-kontroll kort, samt informasjon ift LMWH- og DOAK-behandling
- Epikrise:
- Utskrivende lege: skal anføre årsak til VT (kjente sterke – middels – svake disponerende faktorer, ingen kjente, temporære (transiente / reversible) versus vedvarende risikofaktorer for VT), grunngitt behandlingsvarighet og intensitet (ved Marevan(® tilstrebet PT-INR nivå), og plan for oppfølging og kontroll (evt. behov for kreftscreening og type, trombofiliutredning, økt blødningstendens og hvor slik utredning skal foregå, f.eks. henvisning hematolog). Konferer ansvarlig overlege.
- Pasienten: bestiller seg time hos fastlege om 2-4 uker, for vurdering av effekt, bivirkninger, etterlevelse, evt. malignitetscreening, samt ny time etter 3mnd behandling for samme vurdering og behandlingsvarighet (evt. henvisning hematolog, se under Trombofili)
se over i teksten for Arbeidsbeskrivelse
1. ECS PE Guidelines EHJ 2019 (også publisert i ERJ 2019)
2. ECS PE Guidelines EHJ 2019 – Supplements (Tabs and Figs)
3. ECS PE Guideline Nye og Endrede anbefalinger 2019 Juni 2020
4. CAT Treatment Noen momenter Sept 2022 (Cancer Assosiert Trombose)
5. CAT and DOAKs Dahm Med Sciences 2021
6. DVT dokumenter i EQS:
![]() Retningslinjer
for utredning, logistikk og behandling for pasienter med DVT (Gyldig)
Retningslinjer
for utredning, logistikk og behandling for pasienter med DVT (Gyldig)
![]() Blodsykdommer-
Dyp venetrombose (DVT) - oppfølging og pleie av pasient (Gyldig)
Blodsykdommer-
Dyp venetrombose (DVT) - oppfølging og pleie av pasient (Gyldig)
Referanser: ta kontakt med forfatter om referanser ønskes